杜建忠教授课题组在诊疗一体化高分子囊泡领域取得系列成果
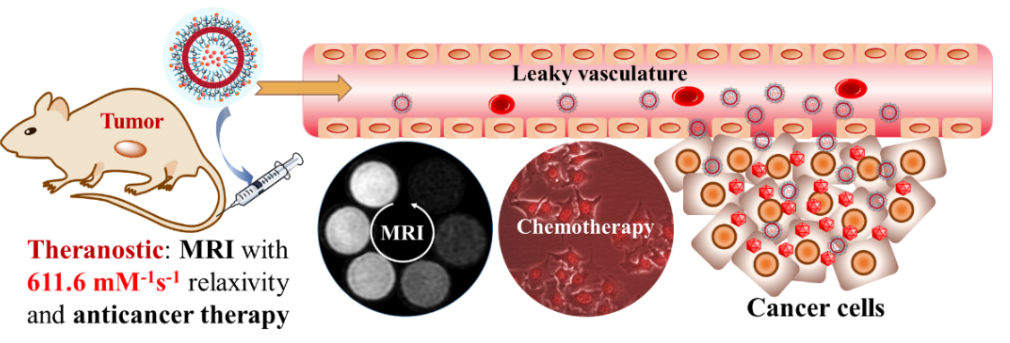
癌症是严重威胁人类生命的疾病,早期检测技术的进步有利于以尽早发现并治疗癌症。磁共振成像(MRI)作为一种高效的肿瘤检测手段,其造影剂对检测灵敏度有重要影响。此外,靶向给药也有利于提高癌症治疗效果。
为了实现上述目的,同济大学高分子材料系杜建忠教授课题组以诊疗一体化高分子囊泡为研究对象,近年来取得了一系列研究成果(J. Mater. Chem.2012,22, 12329;Biomacromolecules2014,15, 1586;ACS Appl. Mater. Interfaces2015,7,14043)。2015年,他们设计了一种具有肿瘤靶向、高效T1造影(r1值达42.39 mM-1s-1)、高效载药的可生物降解不对称高分子囊泡。将造影剂钆包载在囊泡内部后,在大大降低钆毒性的同时,还将其弛豫率提高一个数量级,显著提高了肿瘤检测效果和抗肿瘤效果(Macromolecules2015,48, 739;ESI高被引论文)。
在上述研究基础上,该课题组最近开发了一种新的靶向肿瘤的诊疗一体化高分子囊泡,可同时用于磁共振成像和化疗,其T2弛豫率高达611.6 mM-1s-1。体外和体内实验均证实微量造影剂即可表现出优异的MRI造影效果。该论文还进一步分析了高分子囊泡具有超高弛豫率的原因,为设计更高效的磁共振成像造影剂提供了理论基础。此外,该囊泡还具有很好的肿瘤靶向性。动物实验表明,通过尾静脉注射载药囊泡后,荷瘤裸鼠的肿瘤生长速度明显低于对照组,且在15天后肿瘤逐渐变小,表现了优异的抗肿瘤效果。
该成果于2016年10月15日在国际著名期刊《Biomaterials》上发表(A superparamagnetic polymersome with extremely highT2relaxivity for MRI and cancer-targeted drug delivery)。该期刊是生物材料领域的顶级期刊之一,其最新影响因子为8.387。
上述系列成果为设计高效磁共振成像造影剂提供了理论依据,也为开发靶向肿瘤的诊疗一体化纳米生物医用材料提供了新思路。